Tumores Ováricos en Perras
- 21 de mayo de 2009
- Tiempo de Lectura: 13 Minutos
INTRODUCCIÓN
La literatura científica es abundante en información sobre la incidencia y la etiopatogenia de las patologías ováricas asociadas con infertilidad en animales domésticos como bovinos, equinos y porcinos; no así sobre las patologías ováricas en la perra (González, 2005).
El desarrollo creciente de las técnicas de reproducción asistida y la disponibilidad de medios diagnósticos han conllevado un cambio importante en la disponibilidad de herramientas diagnósticas para identificar patologías reproductivas que antes pasaban desapercibidas o eran sub diagnosticadas. El conocimiento de las patologías ováricas y sus posibles mecanismos etiopatogénicos asociados es un área de creciente interés, debido a la importancia clínica para el médico veterinario que atiende los casos individuales o en la asesoría reproductiva a los criadores.
Las neoplasias ováricas se describen entre el 1 y 6% de las perras de 5 y 15 años de edad. La etiología de las neoplasias es, por lo general, desconocida y multifactorial (González, 2005).
ANATOMÍA DE LOS OVARIOS
Los ovarios son pequeños (longitud media de 2cm) aplanados y de contorno oval elongado. Se encuentran localizados a una corta distancia del polo caudal del riñón, a la mitad de la distancia entre la última costilla y la cresta ilíaca. Están compuestos de una región cortical externa y otra medular interna. La médula tiene grandes vasos sanguíneos, vasos linfáticos y nervios, todos inmersos en una matriz de tejido conjuntivo que contiene algunas bandas de músculo liso. Es característico del ovario de carnívoros la presencia de una red ovárica, correspondiente a restos embrionarios (Rete ovarii), la cual está compuesta de varios cordones sólidos revestidos por células epiteliales. La corteza tiene muchos folículos en diferentes estados de desarrollo o bien cuerpos lúteos, células intersticiales y elementos del estroma, este último conformado por tejido colágeno laxo y densas acumulaciones de fibroblastos.
El ovario está encerrado en un delgado saco peritoneal, la Bursa Ovárica, formada por el mesoovario y la mesosalpinge. La bolsa ovárica está abierta ventralmente a la cavidad peritoneal por medio de una hendidura. La irrigación está dada por las arterias ováricas, ramas directas de la aorta y la inervación por los plexos renal y aórtico que acompañan a las ramas arteriales. El ligamento Suspensorio del ovario, se origina de la fascia transversal medial del extremo dorsal de la última costilla. Su función es sostener al ovario en una posición relativamente fija. El Ligamento Ovárico Propio es corto y une el ovario al extremo craneal del cuerno uterino. Desde este punto, caudolateralmente al canal inguinal, existe un repliegue de la capa lateral del mesometrio que contiene al ligamento redondo del útero (Sisson, 1994).
CLASIFICACIÓN
Los tumores ováricos se clasifican según el tejido de origen. Los tumores del epitelio y del estroma, llamados antes tumores epiteliales comunes, se desarrollan a partir del epitelio de superficie. Los tumores de los cordones sexuales y/o estroma, originados a partir de las células de la granulosa, de la teca, de Sertoli o de las células del estroma ovárico,los tumores de células esteroides que se desarrollan a partir de células luteinizadas del estroma ovárico o delas células de Leydig (hiliares). Los otros son tumores de células germinales (Prat, 2002).

Foto 1 Cistoadenocarcinoma seroso
TUMORES DEL EPITELIO-ESTROMA
Los tumores epiteliales corresponden al 40-50% de los tumores caninos, los de células germinales corresponden al 10% (Ettinger, 2000).
Se originan a partir del epitelio de superficie o de sus invaginaciones (quistes de inclusión) en el seno del estroma. Debido a la capacidad de diferenciación mülleriana de este tipo de epitelio, los tumores que de él derivan pueden ser serosos (células similares a las del epitelio de la trompa de Falopio), mucinosos (células similares a las mucinosas endocervicales), endometrioides y de células claras (semejantes a las que revisten el endometrio) y transicionales. Cada uno de estos subtipos se clasifica en tres categorías de interés pronóstico:, tumores benignos, malignos y de malignidad borderline (tumores de bajo potencial de malignidad) (Prat, 2002).
Los cistoadenomas serosos tienen un tamaño variable; suelen ser quistes uniloculares revestidos por células columnares, frecuentemente ciliadas, que recuerdan a las que se observan en el epitelio de la trompa de Falopio. En algunas ocasiones, por debajo del epitelio, existe un abundante componente conectivo. En estos casos se denominan adenofibromas o cistoadenofibromas (Prat, 2002).
Los tumores malignos, cistoadenocarcinomas papilares serosos, son de gran tamaño y suelen haberse diseminado por el peritoneo en el momento del diagnóstico (Prat, 2002).
Se trata de grandes tumores quísticos, multilobulados con contenido mucoidegelatinoso.
Histológicamente están revestidos por epitelio muco productor que puede ser de dos tipos: similar al de la mucosa intestinal con células caliciformes, o semejante al del endocérvix. En los tumores benignos (cistoadenomas mucinosos) el epitelio está constituido por una sola capa de células, mientras que en los tumores borderline existe moderada estratificación celular. Por el contrario, en los carcinomas mucinosos suele observarse gran complejidad arquitectónica, atipia epitelial e invasión destructiva del estroma. Están constituidos por células epiteliales con tendencia a formar pequeñas papilas pero no es infrecuente encontrar zonas de crecimiento sólido.
En muchos casos se observan microcalcificaciones (Prat, 2002).
En el 2 a 5% de los tumores ováricos mucinosos suele presentarse una complicación grave conocida como pseudo mixoma peritoneal. Ocurre al romperse algún quiste mucinoso con escape de su contenido a la cavidad peritoneal. Como consecuencia, tienen lugar múltiples implantes tumorales en el peritoneo que producen moco y dan lugar a adherencias fibrosas entre las vísceras abdominales, conduciendo a cuadros obstructivos (Prat, 2002).
Los adenofibromas endometrioides tienen un aspecto histológico similar a los pólipos endometriales. En el 40% de los casos, el carcinoma endometrioide es bilateral y en muchas ocasiones se asocia a endometriosis ovárica. Al microscopio presenta rasgos semejantes a los adenocarcinomas de endometrio. A menudo hay diferenciación escamosa. Hasta un tercio de los carcinomas endometrioides del ovario se asocian a carcinomas del endometrio. La supervivencia a los 5 años de las pacientes con adenocarcinomas endometrioides es del 50% (Prat, 2002).

Foto 2 Tumor de células de la granulosa
TUMORES DEL ESTROMA OVÁRICO
Tumor de las células de la granulosa.
Las neoplasias del estroma ovárico se presentan principalmente de tres patrones: células de la granulosa, células de sertoli y patrón no especifico de estroma gonadal. El tipo no específico no están conformado por cualquier tipo de célula de la granulosa o de sertoli y es encontrado solo en la perra.
El tumor de células de la granulosa varía de tamaño de 4 a 16 cm de diámetro y es liso, grueso o nodular. Es el más común del grupo, generalmente unilateral y no es maligno; tiene actividad esteroide, diferenciándose de otras neoplasias ováricas (Moulton, 1978). Foto N°2
La superficie del tumor es lisa y al cortar la superficie puede ser sólida o quística. La porción sólida es blanca o amarilla, dependiendo de la cantidad de lípidos contenidos. Las células en este tumor se asemejan a los compartimentos de los folículos normales, pero éstos histológicamente están organizados completamente diferentes (Jubb; 1993).
En perras, el tumor de células de la granulosa tiene células similares a las que se convierten en los folículos. Las células están alrededor en contorno y tienennúcleos pequeños oscuros que tienen manchas más hipercrómicas y de variados tamaños respecto a los folículos normales. Son comunes las figuras mitóticas. Algunas células tienen manchas de luz o citoplasma espumoso similar al del tumor de las células de sertoli; pero usualmente las células tienen manchas eosinofílicas oscuras en el citoplasma (Moulton, 1978).
TUMORES DE LAS CÉLULAS GERMINALES.
Disgerminoma
El disgerminoma (carcinoma embrional, carcinoma células grandes y seminoma ovárico) es un tumor epitelial de células vesiculares grandes de gónadas sexuales embriológicamente indiferenciadas. Este tumor tiene estructuras microscópicas que se asemejan de la estructura del seminoma de testis, pero no secreta hormonas. Foto N°3.
Es muy raro en animales domésticos, con sólo unos pocos casos en perra, gata y vaca, en orden de frecuencia. Se presenta en animales adultos, con una edad de 13 años, sin prevalencía de raza. La metástasis ocurre en el 10-20% de los casos. El disgerminoma es usualmente una gran masa suave unilateral de 6 a 15 cm de diámetro alrededor el ovario, bien definido, con una superficie externa lisa lobulada y de color blanco grisáceo homogéneo o café amarillento; algunas veces puede tener áreas de hemorragia o parches amarillos de necrosis (Moulton, 1978).
Está compuesto por una población uniforme de células grandes con grandes núcleos centrales cromáticos. Las figuras mitóticas y las células gigantes son frecuentemente divididas en compartimentos con tejido conectivo. Las figuras mitóticas son comunes; el patrón de crecimiento es difuso. El estroma es siempre escaso. Como en el seminoma testicular canino, la acumulación de linfocitos está presente en este tumor (Jubb, 1993).
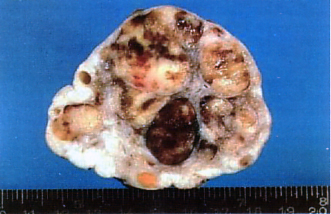
Foto 3 Disgerminoma
Teratomas
Son observados rara vez en animales domésticos. Tiene áreas sólidas y estables que contienen material sebáceo y pelo. Otros tejidos pueden estarpresentes como el tejido neural, adiposo, hueso y epitelio respiratorio (Jubb, 1993).
SIGNOS CLÍNICOS
La mayoría de las neoplasias ováricas benignas no producen síntomas a no ser que sean de gran tamaño. Los signos que podemos encontrar son:
Distensión abdominal, masa abdominal palpable, descarga vulvovaginal, comportamiento estral anormal, polidipsia poliuria, disnea, anorexia, actitud letárgica, pérdida de peso. No se presentan alteraciones significativas en la bioquímica sanguínea (Morgan,1999).
Por lo general, las manifestaciones clínicas de problemas endocrinos incluyen la presentación de alopecia bilateral simétrica, hiperpigmentación, hiperqueratosis y no hay evidencia de prurito. Cuando el cuadro se complica con pioderma o seborrea, aparece el prurito (Lacroix, 2005).
Piometra, hiperplasia endometrial quística, estro prolongado, agrandamiento de los pezones y de la vulva, así como descarga vaginal se detectan ocasionalmente (Moulton, 1978).
DIAGNÓSTICO
Los antecedentes anamnésicos son de importancia en pacientes infértiles, con ciclos irregulares, apareamientos y gestaciones previas, etc. (Purswell, 2001).
La evaluación ginecológica se hace con el objetivo de detectar anormalidades del aparato reproductor (genitales externos), observar la presencia de secreciones anormales (pus), neoplasias y detectar si existe inflamación. Es necesario la realización del tacto vaginal o la utilización de técnicas como la vaginoscopía (Lacroix, 2005).
Medición de hormonas: se basa principalmente en la detección de concentraciones anormales en sangre de la hormonas implicadas. Las dos técnicas más comúnmente utilizadas son el radioinmunoanálisis (RIA) y las pruebas de ELISA. Para la progesterona las unidades se expresan en ng/ml y para los estrógenos en pg/ml. Las hormonas se producen en pulsos y su secreción se ve afectada por factores como la edad, sexo, raza y ciclos circadianos (horas del día), por eso es muy importante no basar el diagnóstico exclusivamente con el resultado obtenido de una sola muestra. Es necesario tomar varias muestras para poder medir el nivel basal de la hormona y así poder detectar sus fluctuaciones (Matamoros y Gómez, 2002).
La ultrasonografía es una técnica confiable para determinar el tamaño, forma y contenido de una masa. Los ovarios tienen un tamaño pequeño y, cuando son afectados por una neoplasia, es difícil identificar el tejido ovárico normal. Tienen una localización definida, precisa, caudal a los riñones y esto debe ser usado como parámetro anatómico.
El diagnóstico de masa ovárica es realizado por exclusión de otras masas (renales, esplénicas, nódulos linfáticos). Podemos clasificar a los tumores ováricos en: a) sólidos (adenocarcinoma, tumores de células granulosas), b) sólidos con componentes quísticos (adenocarcinoma, tumor de células granulosas, disgerminoma), c) quísticos (adenomas, teratomas).
Todas las masas tienen eco estructura hipoecoica homogénea; las cavidades quísticas que se pueden presentar van de 0.2 a 3.5 cm de diámetro, siendo éstas anecoicas, de paredes lisas, redondeadas y con refuerzo de ecos posteriores, únicas o múltiples. El tamaño tumoral, visible por ecografía, va de los 3.5 cm hasta los 10 cm de diámetro. Los contornos son bien definidos en todas las masas, en algunas lisos y en otras irregulares o nodulares. La utilización de Doppler color para diferenciar tumores benignos de malignos en los caninos está en fase de investigación (Saharrea, 1999).
La radiografía ayuda a encontrar masas tumorales en la cavidad abdominal.
La laparotomía exploratoria conduce al diagnóstico definitivo, luego se toman biopsias para histopatología a fin de realizar la diferenciación entre los tumores (Ettinger, 2000).
TRATAMIENTO:
La ovariohisterectomía es el tratamiento primario para todos los tipos de neoplasias ováricas. Se debe evitar romper la cápsula, para evitar posibles metástasis. En el caso del disgerminoma se recomienda la radioterapia en caso de existir metástasis (Ettinger, 2000).
También en casos de metástasis se puede realizar quimioterapia en base a diferentes protocolos, entre los que destaca:
Fluoruracilo (150 mg/m2, IV. una vez por semana) más Ciclofosfamida (50 mg/m2 P.O. día de por medio).
Vincristina (0.5 mg/m2 IV. días 81522), asociado a Doxorubicina (20-30 mg/m2 IV. día 1) y Ciclofosfamida (200-300 mg/m2 día 15) (Álvarez, 2003).
REFERENCIAS BIBLIOGRÁFICAS
ÁLVAREZ, P. . 2002-2003. Recipe Vademecun veterinario. Edit. Talleres gráficos de la nación, J.J impresores. Santiago.
ETTINGER, S.; E. FELDMAN. 2000. Textbook of veterinary interna¡ medicine. W.B. Saunders Co. 5a Ed. Vol. 1. Philadelphia.
GONZÁLEZ, M. 2005. «Infertilidad en una perra con historia de falla reproductiva recurrente asociada con tumor de células de la granulosa». Revista colombiana de ciencias pecuarias. Universidad de Antioquía. Vol. 18:3. Medellín, Colombia.
JUBB, K. 1993. Pathology of domestic animals. Acad. Press. 41 Ed. Vol. 3. 364 -370 USA.
LACROIX, C. 2005. Alteraciones del aparato reproductor de la perra. AMMVEPE, https://www.ammvepe.com/ articulos.html
MATAMOROS, R. y C. GÓMEZ. 2002. Hormonas de utilidad diagnóstica en Medicina Veterinaria. Arch. Med. Vet. Vol. 34. 167-182.
MORGAN, R. 1999. Clínica de pequeños animales. Harcourt brace. 3a Ed. España.
MOULTON, J. 1978. Tumors in animals: Edit. Universidad de California. 21 Ed. LondresInglaterra.
PRAT, J. 2002. Ginecología oncológica. Servicio de anatomía patológica. Universidad autónoma de Barcelona, Hospital de la santa creu i sant pau. Ediciones ERGON S.A. Madrid.
PURSWELL. 2001. Infertilidad en la perra. Selecciones Veterinarias. Vol. 9 -N°2.
SAHARREA C. 1.999 Evaluación ecográfica de útero y ovario en la Perra. Cap. VI. Vol. VIII N° 80. www.diagnostico.com.ar
SISSON y GROSSMAN. 1994. Anatomía de los animales domésticos. Edit. Salvat. 5a Ed. Vol. 2 Barcelona.
Autores: Dra. Sandra Galarza V., M.V.; Dr. Julio Thibaut L., M.V. Inst. Ciencias Clínicas Veterinarias. Fac. Ciencias Veterinarias. Universidad Austral de Chile.
Fuente: Mevepa.cl