HISTOPATOLOGÍA DE EFUSIONES: Es posible…!
- 7 de junio de 2016
- Tiempo de Lectura: 5 Minutos
Existen diversos motivos por los cuáles necesitamos hacer un bloque de parafina con material obtenido de una aspiración de fluidos. Muchas veces el motivo es que no contamos con el equipo necesario para evaluar las muestras o desconocemos la correcta técnica de evaluación citológica. En otras oportunidades quizá queremos preservar de la mejor forma posible la microarquitectura de las células obtenidas y no correr el riesgo de dañar las cromatinas al realizar el montaje. Otra posible justificación sea la de trabajar con un muy buen Patólogo que prefiere siempre evaluar cortes histológicos antes que frotis citológicos. Independientemente del motivo, es importante saber que con materiales muy simples podemos convertir un posible sedimento celular en un bloque de parafina de aceptable calidad para estudios histológicos e inmunológicos.
Esta técnica se puede practicar en todas las efusiones que se cree o compruebe que son muy celulares como podrían ser:
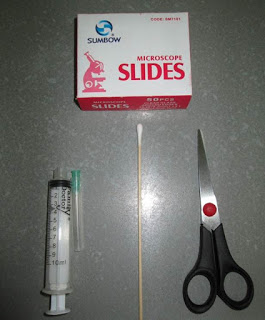
Para poder realizar la toma de muestra y crear nuestro pseudotejido o biopsia necesitaremos materiales de uso rutinario (Fig.1) en cualquier clínica o laboratorio:
Para comenzar es recomendable colectar la efusión o líquido directamente mediante una jeringa de 5cc o 10 cc dependiendo de la cantidad de muestra disponible y siempre guiados por un ultrasonido para evitar punzar estructuras que no son parte del estudio. En casos de muestras que sabemos previamente que serán de pocos mililitros podemos colocar el algodón en la aguja y aspirar directamente del tejido. Si la muestra es abundante se debe guardar una porción del líquido de forma estéril para cultivo. Disponer de una gota para un frotis directo. Luego colocar el resto de la colecta en una centrífuga para tubos de ensayo estándar a 3000 – 5000 rpm por 15 minutos.
Al terminar el trabajo de la centrífuga separar el sobrenadante para medición de gravedad específica, proteínas y otras pruebas. El sedimento es homogeneizado en el sobrenadante residual y se dispone de un gota para frotis directo.
1. Asegurarnos de contar con todos los materiales necesarios antes de realizar cualquier aspirado.
2. Cortamos la punta del Hisopo o Cotonete(Fig.2). Es deseable descomprimirlo ligeramente para evitar obstrucciones. Existen varios tipos y calidades de algodón. Deben experimentar con varias para encontrar la calidad que les permita realizar aspirados más confortables.

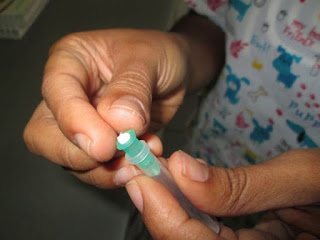
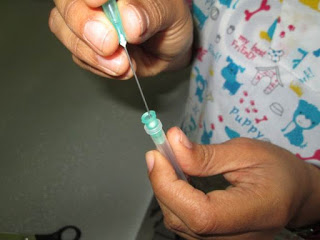
3. Introducimos el algodón en la campanilla de la aguja (Fig.4). Lo acomodamos al final de la campanilla (Fig.5).
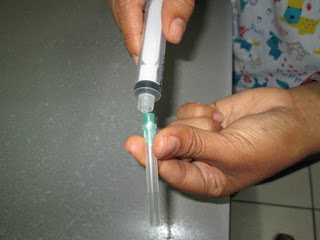
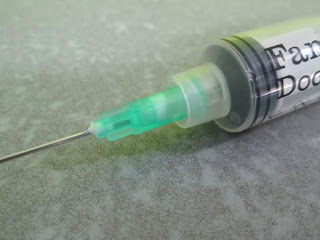
4. Con el algodón en su lugar(Fig.7) y una vez ajustada la aguja a la jeringa realizamos el aspirado de la efusión(Fig.8). Este procedimiento se realiza lentamente tratando de vencer la resistencia del algodón. Si hay una obstrucción proceder a usar un nuevo algodón menos denso.
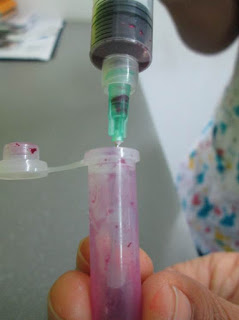
5. Con la ayuda de otra aguja retiramos el algodón de la campanilla(Fig.9) con mucho cuidado para luego ser colocado en formaldehido al 10%. Si se dificulta la extracción del algodón se recomienda realizar un pequeño doblez en la punta de la aguja para que funcione como garfio. Es recomendable usar rejilla de transporte o un tubo Eppendorf para evitar el deterioro de la muestra por exceso de turbulencia.
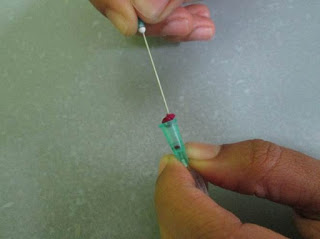

Es importante saber que ésta técnica no remplaza a ninguna biopsia tradicional que se pueda realizar. Siempre será mejor obtener biopsias de tejido mediante Punch, Sacabocados o Agujas Trucut. Las biopsias tradicionales preservan mucho mejor la arquitectura del tejido y en histopatología el tamaño de la muestra siempre será importante.
Los resultados obtenidos son variables y van a depender de una cadena de decisiones adecuadas respecto a la mejor forma de proceder en un caso particular.
Existen muchas variantes similares de está técnica que usan agarosa o microcapilares con el mismo objetivo de colocar en un bloque de parafina el material obtenido de muestras líquidas con mucho volumen.
La técnica descrita en este trabajo es una alternativa útil para el trabajo rutinario de los clínicos, patólogos clínicos y anatomopatólogos. Sin embargo existen pruebas con resultados de mayor calidad pero de mayor complejidad para el clínico promedio. Queda a criterio del lector e investigador el uso o aplicación de la técnica mencionada en este trabajo.
Referencias Bibliográficas: