Caso clínico: Reporte del 1° Caso de Esporotricosis Canina en Chile
- 23 de mayo de 2024
- Tiempo de Lectura: 17 Minutos
Nota basada en el artículo de investigación de: Ailén D.; Carlos González. Belén Rivera, Isidora Mercy y Pamela Thomson. Titulado: Challenging frontiers: Canine sporotrichosis due to Sporothrix brasiliensis, first case in Chile.
CASO CLÍNICO
Llega a consulta una hembra dálmata intacta de 5 años fue remitida para una segunda opinión a una clínica veterinaria el 15 de febrero de 2023 con antecedentes de un año de evolución gradual de la piel con un patrón ulcerativo que afectaba las extremidades distales y la frente. La paciente no tenía antecedentes de haber viajado hacia o desde áreas endémicas donde se haya descrito previamente S. brasiliensis, ni antecedentes de haber estado en contacto con gatos domésticos sanos o infectados. La propietaria informó que había sido tratada con altas dosis de prednisona y antibióticos, pero con sin mejoría.
Al examen físico presentó alopecia cicatricial multifocal, eritema, diversas fístulas con varios canales de drenaje y lesiones cutáneas ulcerosas con pus ( Fig. 1 ). El paciente se encontraba levemente letárgico, con signos de dolor moderado y puntuación de condición corporal de 4/9. Los ganglios linfáticos estaban dentro de los parámetros normales. En la primera cita se realizó citología con hisopo que mostró inflamación neutrofílica, neutrófilos degenerados, macrófagos vacuolados, no se encontraron microorganismos ni queratinocitos nucleados. En esta oportunidad se solicitó cultivo bacteriano y antibiograma del corte de las lesiones, además de hemograma y perfil bioquímico. En espera de este resultado, al paciente se le administró una dosis única de cefovecina a dosis de 8 mg/kg (Zoetis, Las Condes, Chile).
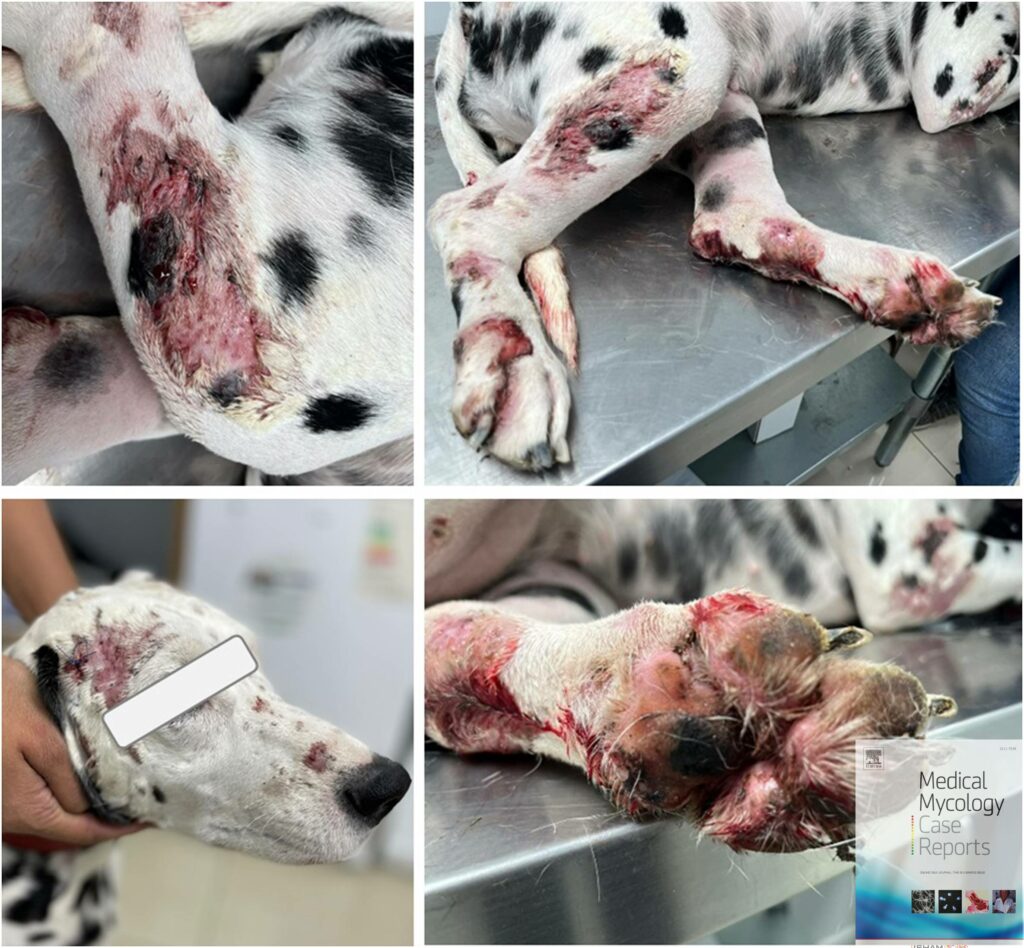
Figura 1 . Paciente con lesiones ulceradas, húmedas y sanguinolentas distribuidas en extremidades anteriores, posteriores y cara.
El hemograma completo reveló anisocitosis leve, poiquilocitosis, policromasia, neutrófilos degenerados, desviación izquierda, normocítica normocrómica y anemia regenerativa; mientras que la bioquímica sanguínea elevó la fosfatasa alcalina (500 UI/L). El cultivo y antibiograma mostraron sensibilidad de Staphylococcus pseudointermedius a enrofloxacino; clindamicina; eritromicina y vancomicina. Al perro se le recetó prednisona 1 mg/Kg (Laboratorio Chile, Ñuñoa, Chile) y enrofloxacino 5 mg/Kg (Rostrum, Drag Pharma, Quilicura, Chile) durante 15 días; después de ese período, no se observaron signos de mejoría. Se realizó una biopsia incisional de una de las lesiones ulcerosas ubicadas en la extremidad anterior derecha para análisis histopatológico.
El estudio histopatológico reveló hiperqueratosis, acantosis y ulceración a nivel epidérmico. Mientras que, el tejido dérmico y subcutáneo mostró la presencia de una intensa inflamación piogranulomatosa, que consistió principalmente en histiocitos epitelioides, células gigantes multinucleadas. En el tejido circundante había infiltración con neutrófilos y linfocitos. Se detectaron numerosos elementos fúngicos dentro del citoplasma de los histiocitos o, ocasionalmente, de células gigantes multinucleadas. Por lo general, se caracterizaban por estructuras parecidas a levaduras, redondas u ovaladas, con una pared celular gruesa y refringente, que a menudo aparecían como grupos. Los elementos fúngicos fueron positivos a la tinción PAS, lo que indica la presencia de paredes celulares fúngicas ricas en polisacáridos. Se observó afectación de algunos pequeños vasos sanguíneos con signos de vasculitis o trombosis asociada a áreas necróticas ( Fig. 2 ).
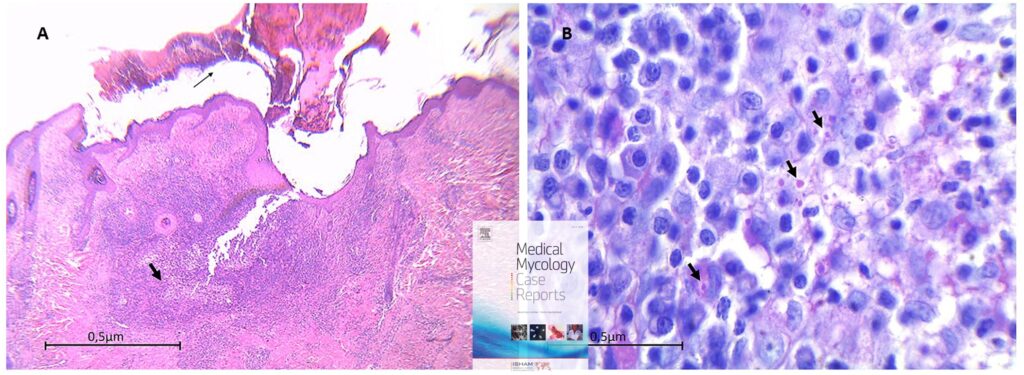
Figura 2 . A. La biopsia de piel muestra hiperqueratosis, acantosis y ulceración a nivel epidérmico, con una costra necrótica gruesa (flecha delgada). Mientras que el tejido dérmico y subcutáneo mostró la presencia de intensa inflamación piogranulomatosa nodular con fistulización (flecha gruesa). Tinción H/E 40x. B. A mayor aumento la inflamación piogranulomatosa subcutánea que consistía principalmente en histiocitos y linfocitos epitelioides, con presencia de menos neutrófilos. Se detectaron algunos elementos fúngicos positivos a la tinción PAS dentro del citoplasma de los fagocitos. Tinción PAS 1000x.
Posteriormente, se recomendó tomar un nuevo procedimiento de muestreo de las lesiones restantes y enviarlo al Laboratorio de Microbiología Clínica y Microbioma, de la Facultad de Medicina Veterinaria de la Universidad Andrés Bello. En espera de los resultados del cultivo fúngico, se inició clotrimazol tópico al 1% dos veces al día (Laboratorio Chile, Santiago, Chile); baños con miconazol 2% + clorhexidina 2% (Regepipel, Drag Pharma, Quilicura Chile) dos veces por semana y terbinafina oral 40 mg/kg/una vez al día (Laboratorio Chile, Santiago, Chile) [ 12 ], durante cinco semanas y se realizó una nueva revisión. hecho, donde el propietario no vio ninguna mejora.
La identificación polifásica se realizó en una cabina de bioseguridad BSL-2. Inicialmente se realizó un examen microscópico directo de la muestra con tinción Diff Quick, donde se observaron blastoconidias escasas. Luego, la muestra de tejido se picó y se sembró en agar glucosa Sabouraud (SGA) que contenía cloranfenicol (0,05 g/l) y cicloheximida (0,4 g/l) (Merk, Rahway, Nueva Jersey, EE. UU.), y se incubó a 25 °C y 37 °C durante 10 días. Las características macro y micromorfológicas de la colonia permitieron la identificación presuntiva de Sporothrix spp. Mientras tanto, el estudio genotípico de la colonia aislada incluyó la extracción de ADN realizada con el kit Quick-DNA Fungal/Bacterial (Zimo Research, Irvine, CA, EE. UU.), siguiendo las instrucciones del fabricante. La amplificación por PCR se realizó utilizando los cebadores universales ITS5, ITS4 y calmodulina. Las secuencias obtenidas fueron editadas, ensambladas y analizadas comparando la similitud de nucleótidos utilizando la herramienta BLAST del Centro Nacional de Información Biotecnológica (NCBI). Las secuencias de aislados que presentan 100% de identidad genética con S. brasiliensis (código de acceso OR852420, PP083686).
La concentración mínima inhibitoria (CMI) se determinó mediante microdilución en caldo, según el documento M38-A2 del Instituto de Estándares Clínicos y de Laboratorio (CLSI) (estándar CLSI M38) [ 13 ]. Los medicamentos probados fueron anfotericina B (AMB), fluconazol (FLC), itraconazol (ITR), ketoconazol (KET), posaconazol (POS), voriconazol (VRC) y terbinafina (TRB) (Sigma-Aldrich, St. Louis, MO, EE.UU). Brevemente, se preparó un inóculo de cada cepa de 1-5 × 10 4 conidios/ml en solución salina estéril, incluidas las cepas. Las CMI se determinaron mediante inspección visual después de 48 a 72 h de incubación a 35 ° C (estándar CLSI M38) [ 13 ]. Los azoles demostraron buena actividad contra las cepas analizadas, mostrando un rango de CMI de 0,25 a 1 μg/ml, con excepción del fluconazol que mostró una CIM >64 μg/ml. AMB mostró valores de CIM entre 0,5 y 1 μg/mL, sin embargo TRB mostró CIM >16 μg/mL.
El paciente aún no respondía después de cinco semanas con terbinafina, por lo que se inició con itraconazol (10 mg/kg/sid) durante dos semanas. Durante el tratamiento con este nuevo medicamento antifúngico, el dueño informó que el perro tenía dolor y dificultad para caminar, por lo que rechazó la terapia y decidió sacrificar al paciente por su mala calidad de vida.
En cuanto a los signos del paciente, estos coincidieron con los informados en la literatura anterior [ 7 , 9 , 18 ]. Al perro en este informe se le diagnosticó una presentación cutánea sin afectación de los ganglios linfáticos y un patrón ulcerativo que afectaba las extremidades distales y la frente, lo cual concuerda con Gómez-Gaviria et al. [ 17 ] hallazgos, donde la forma de enfermedad más frecuente fue la cutánea, con el 54,5% de los casos de los perros estudiados, y con Sepúlveda Boechat et al. [ 7 ] donde del total de 47 perros, 19 reportaron lesiones cutáneas y 19 lesiones mucosas y cutáneas. Mientras que en Barreto Fernandes Figueiredo et al. [ 19 ] informan que las presentaciones más frecuentes fueron la forma mucosa y la forma cutánea localizada/fija. En general, todos los informes mencionados anteriormente describieron ulceraciones en las extremidades y en la frente u otras zonas de la cara. Además, los parámetros sanguíneos del paciente mostraron similitudes con informes anteriores, destacando la inflamación piogranulomatosa [ 20 ] y la anemia regenerativa normocítica normocrómica [ 18 ].
Entre los tratamientos disponibles para la esporotricosis canina, el itraconazol ha sido el más utilizado hasta la fecha, solo o asociado con otros fármacos [ 7 ]. Además, según Gremião, es un antimicótico de primera línea para el tratamiento de la esporotricosis humana y animal [ 5 ].
Antes de recibir los resultados de la prueba antifúngica, el paciente inició tratamiento con el agente antifúngico terbinafina, pero no se detectaron signos clínicos de recuperación, y posteriormente demostró no tener suficiente actividad “in vitro” . Existe evidencia de que la terbinafina se ha utilizado anteriormente para el tratamiento de la esporotricosis canina con resultados exitosos [ 13 ], sin embargo, no es el antifúngico de primera elección. Luego se prescribió itraconazol durante dos semanas hasta la reevaluación clínica. Sin embargo, el propietario optó por la eutanasia en otro centro veterinario.
Los autores destacan la importancia de un diagnóstico rápido, después del cual se pueden tomar decisiones adecuadas sobre el mejor tratamiento individual para cada paciente junto con un seguimiento adecuado [ 5 ]. Se recomienda realizar los estudios pertinentes en caso de sospecha de esporotricosis para prevenir la propagación de la enfermedad en caso de confirmación. Además, se recomienda encarecidamente seguir las recomendaciones de tenencia responsable de mascotas y animales de compañía. Como resultado, se reduce el contacto entre animales domésticos y salvajes y por tanto la posibilidad de transmitir el hongo a la vida silvestre. Esto pone de relieve la importancia de abordar el problema desde la perspectiva de Una Salud [ 7 ].
Considerando la rápida expansión de S. brasiliensis en Brasil durante la última década [ 5 ], los autores enfatizan la necesidad de tomar medidas no solo para poder detectar y confirmar la infección sino también proponer estrategias para prevenir y controlar este hongo en Chile. , país que apenas comienza a observar los primeros casos de esporotricosis por S. brasiliensis . Para obtener finalmente resultados exitosos, es necesario seguir el enfoque de Una Salud como punto clave para el desarrollo de medidas apropiadas y efectivas, con la participación y aportes de todos los miembros de la sociedad.
Nota basada en el artículo de investigación de: Ailén D.; Carlos González. Belén Rivera, Isidora Mercy y Pamela Thomson. Titulado: Challenging frontiers: Canine sporotrichosis due to Sporothrix brasiliensis, first case in Chile. [ https://www.sciencedirect.com/science/article/pii/S221175392400006X#sec8]
________________________________________________________________________________________________________
¿Quieres encontrar la solución a los diagnósticos más desafiantes de Dermatología Canina
Inscríbete ahora al curso virtual de Dermatología Clínica Canina. Haz click 👉AQUÍ.